2012年,年仅7岁的患儿Emily Whitehead在经历两次白血病复发后,已经命悬一线。此时,化疗已经失效,病情已经失控,她的父母在多番考虑后,最终决定带着她来到费城儿童医院,加入了当时还在摸索的一项疗法的临床试验,这项疗法即现在耳熟能详的CAR-T疗法。
作为有史以来第一位接受CAR-T疗法的白血病患儿,Emily在接受多个治疗疗程后,体内的癌细胞竟然彻底消失了。如今,她已经长大成人,8年多都没有癌症复发。而这些年来,CAR-T疗法也在飞速发展。中美已经批准多款CAR-T疗法上市,血液肿瘤免疫治疗的新篇章也就此展开。
CAR-T疗法的重中之重就是高效利用T细胞,其中核心部件CAR的全称是“嵌合抗原受体”,它包含了一个能结合肿瘤相关抗原的结构。这意味着,经过人为改造的T细胞,可以像抗体一样精准锁定肿瘤细胞上的抗原,达到杀灭肿瘤的效果。而Emily也曾接受了这类改造T细胞的回输,成功帮助她战胜了癌症。
治疗Emily的CAR-T疗法针对的是CD19蛋白。这是一类在许多血液肿瘤细胞上高度表达的分子。因此通过制造针对这一分子的CAR-T细胞,就可以开展高效的肿瘤猎杀行动。但遗憾的是,肿瘤细胞作为一种极其狡猾的个体,也会采取方法来抵抗治疗:它们可能会在治疗过程中逐渐降低,甚至完全不表达CD19!
在一种叫做大B细胞淋巴瘤(LBLC)的血液肿瘤里,复发的患者中,有62.5%的CD19表达已经缺失或者很低。这意味着,现有针对CD19的导航系统会失效,T细胞找不到CD19也就发挥不了作用。
既然单个导航不好使,我们再添加一个靶标,让T细胞双管齐下是不是就能保证疗效了?最近一期的《自然-医学》就展示了一种双特异性的CAR-T疗法。来自斯坦福大学的研究者在CD19之外,将CD22当作了T细胞的第二靶标。

许多B细胞肿瘤也会表达CD22分子。就过往研究来看,先使用针对CD19的CAR-T疗法,再使用针对CD22的CAR-T疗法就能使患者获得73%的完全缓解率。无论患者是否表达CD19,这种联合疗法都能获得同样的效果。因此,在靶标CD19的基础上搭配CD22,组成双特异性的CAR分子来导航,确实是一个不错的选择。
研究者招募了39位B细胞肿瘤患者参与1期临床试验,包括17名急性淋巴细胞白血病(B-ALL)患者和22名LBLC患者,其中38位接受了双特异的CAR-T疗法治疗。当然,疗法能否起效关键在于改造的T细胞能不能存活。研究者在将改造T细胞回输到患者体内后,能通过多种方式(包括流式细胞术、定量PCR)从血液样本中检测到改造T细胞的存在,并且数量会在回输10-14天后达到顶峰。
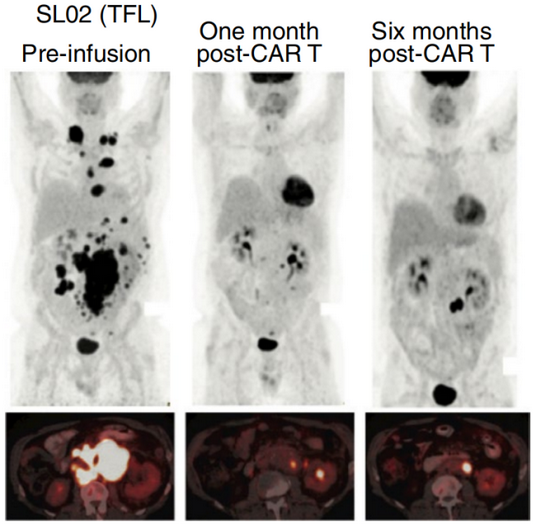
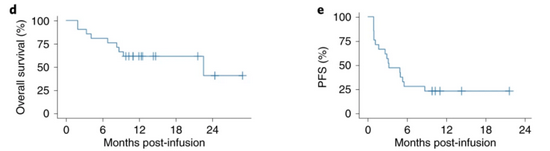
随后,研究者在T细胞回输3个月后对患者作出了初步评估,在LBCL组中,15名接受了推荐剂量治疗的患者,总缓解率(ORR)和完全缓解率(CR)分别达到了40%和33%。对所有LBCL病人来说,最好的ORR和CR分别达到62%和29%。在后续长达10月的随访评估中,研究者指出,接受治疗之后患者的总体生存期中位数可以达到22.5个月,并且随着随访时间的推进,这一数字还将不断上升,也就是说在未来患者的生命还将得到延续。
此外,一些显示肿瘤存在的指标也会随治疗而好转。研究中,有16名病人接受了循环肿瘤DNA(ctDNA)检测,这一指标能很好地反应血液中癌细胞的存在情况。根据检测结果,4名接受治疗后,临床反应较好的患者在最近的一次评估中,已经检测不到来自肿瘤的ctDNA;12名仍伴有疾病进展的患者,在回输双特异性的CAR-T细胞14-21天后,同样也能看到ctDNA不断下降的趋势,这说明肿瘤确实正在被改造T细胞不断清除。
而B-ALL组的情况更加乐观,T细胞回输28天后,该组17名患者的病情都能得到缓解,其中CR达到了82%,6个月后,总体的CR已经达到88%。根据随访9个多月数据,患者总体生存期中位数可达11.8个月。
两个组别的结果说明,针对CD19-CD22的CAR-T疗法对两种血液肿瘤都能起到显著的治疗效果,并且不需要针对不同靶标分开、多次进行治疗,双特异性的CAR-T细胞可以一次性就能完成效果。
综合来看,单单针对CD19来治疗B细胞肿瘤或许是不足够的,未来针对两个靶标的双特异CAR-T疗法或许是更有效的抗癌手段。目前,研究团队正尝试改进双特异CAR-T细胞的制造过程,再进行后续的临床测试。
赞赏 微信赞赏
微信赞赏 支付宝赞赏
支付宝赞赏













最新评论
exyeuer 在《“人口红利”概念的邪恶之处》上说:
henry 在《日本开发出一种抗衰老疫苗》上说:
匿名用户 在《2015年,马云湖畔大学,一个极其危险的政治信号》上说:
焦点新闻 在《美国女模特戴特朗普面罩呼吁粉丝投票》上说:
匿名用户 在《“鼓励农民进城”是一个大骗局》上说: